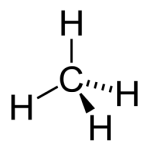
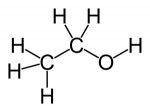
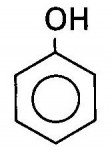
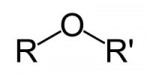
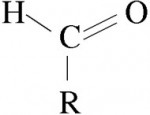
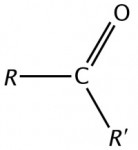
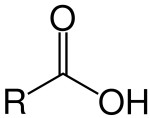
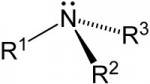
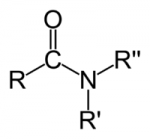
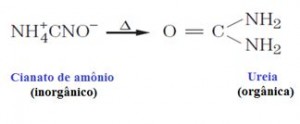
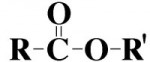O enorme número de compostos orgânicos existentes nos obriga a agrupá-los em classes semelhantes, denominadas Funções Orgânicas. Função Orgânica é um conjunto de substâncias com propriedades químicas semelhantes (denominadas Propriedades Funcionais).
Outra tarefa dificílima é dar nomes a milhões de compostos orgânicos. Até o século passado, os nomes eram dados arbitrariamente, apenas lembrando a origem ou alguma característica dos compostos (o Ácido Fórmico, por exemplo, recebeu este nome por ser encontrado em formigas).
Com o crescimento do número de compostos orgânicos conhecidos a situação foi se complicando de tal modo que, os químicos, reunidos no Congresso Internacional de Genebra (1892), resolveram iniciar uma racionalização na nomenclatura orgânica. Após várias reuniões internacionais, surgiu a denominada Nomenclatura IUPAC (sigla para "Inernational Union of Pure and Applied Chemistry", isto é União Internacional de Química Pura e Aplicada).
A nomenclatura IUPAC é formada por inúmeras regras, com objetivo de se dar nomes bastante lógicos aos compostos orgânicos, de modo que:
Cada composto tenha um nome diferente que os distinga de todos os demais;
Dada a fórmula estrutural de um composto, seja possível elaborar seu nome e vice-versa.
A nomenclatura oficial da IUPAC leva em consideração o número de Carbonos, os tipos de ligações entre eles e a função a que pertencem às substâncias. Assim, o nome de uma cadeia aberta normal é composta por três partes: umprefixo, que indica o número de átomos presentes na cadeia, um intermediário, que indica o tipo de ligação entre os átomos de Carbono, e um sufixo, que indica a função a que pertence o composto orgânico. Veja a tabela abaixo:
Prefixo
|
Intermediário
|
Sufixo
|
Número de Carbonos
|
Ligações Entre Carbonos
|
Função
|
1 - MET2 - ET3 - PROP4 - BUT5 - PENT6 - HEX7 - HEPT8 - OCT9 - NON10 - DEC11 - UNDEC...
|
só ligações simples - AN1 ligação dupla - EN2 ligações duplas - DIEN3 ligações duplas - TRIEN ...1 ligação tripla - IN2 ligações triplas - DIIN3 ligações triplas - TRIIN1 dupla e 1 tripla ligação - ENIN
|
Varia de acordo com a função
|
Hidrocarbonetos são compostos orgânicos formados exclusivamente por átomos de Carbono e Hidrogênio. Eles se subdividem em várias subclasses, das quais as mais importantes são alcanos, alcenos, alcinos, ciclanos (ou cicloalcanos) e aromáticos.
Alcanos ou Parafinas são Hidrocarbonetos acíclicos e saturados. Sua nomenclatura é dada utilizando o intermediárioAN e o sufixo O, ou seja, os nomes dos alcanos possuem prefixo de numeração e ANO no final. Veja os exemplos:
|
|
|
|
|
1 Carbono + ANOMetano
|
2 Carbonos + ANOEtano
|
3 Carbonos + ANOPropano
|
4 Carbonos + ANOButano
|
As fórmulas moleculares de todos os alcanos se encaixam na FÓRMULA GERAL CnH2n+2,onde n é um número inteiro. Assim, por exemplo, no Octano temos n = 8 átomos de Carbono e, conseqüentemente, 2n + 2 = 2 8 + 2 = 18 átomos de Hidrogênio, e fórmula molecular C8H18.
Alcenos, Alquenos ou Olefinas
|
Alcenos são Hidrocarbonetos acíclicos contendo ligações duplas. Sua nomenclatura é dada utilizando o intermediário EN e o sufixo O e possuem fórmula geral CnH2n, onde n é um número inteiro. Veja os exemplos abaixo:
|
|
|
2 Carbonos + ENOEteno
|
3 Carbonos + ENOPropeno
|
Obs: O Eteno também é chamado de Etileno
|
Em casos onde existem mais de uma possibilidade para a posição da dupla ligação, é necessário indicar a sua posição, através de uma numeração. O Carbono 1 é sempre o Carbono da extremidade mais próxima da dupla ligação na cadeia, fazendo com que sejam usados os menores números possíveis. Veja os exemplos abaixo:
|
|
|
Ligação dupla no Carbono 1 + 5 Carbonos + ENO1-Penteno
|
Ligação dupla no Carbono 2 + 6 Carbonos + ENO2-Hexeno
|
Há também um outro tipo de Alcenos, os Alcadienos ou Dienos. Eles são caracterizados pela presença de duas ligações duplas em sua estrutura. Sua nomenclatura é igual ao dos Alcenos, porém utiliza antes do intermediário EN o prefixo DI, para indicar duas ligações duplas. Em sua numeração, deve-se numerar a cadeia de tal forma que as ligações duplas tenham os menores números possíveis. Em Dienos com 3 Carbonos, fica óbvio que não é necessário numerar.
|
|
|
Ligação dupla no Carbono 1 + Ligação dupla no Carbono 2 + 4 Carbonos + DIENO1,2-Butadieno
|
Ligação dupla no Carbono 1 + Ligação dupla no Carbono 3 + 5 Carbonos + DIENO1,3-Pentadieno
|
Vale a pena acrescentar que também podem existir os Trienos, Tetraenos, etc.
São Hidrocarbonetos Alifáticos Insaturados contendo triplas ligações. Possuem nomenclatura igual a dos alcenos, porém o seu intermediário é IN. Possuem fórmula geral CnH2n-2. Os Alcinos podem ser classificados em dois grupos:Verdadeiros e Falsos. Os Alcinos Verdadeiros possuem um átomo de Hidrogênio ligado a um dos Carbonos contendo a tripla ligação. Os Alcinos Falsos não possuem Hidrogênio ligado ao átomo de Carbono com a tripla ligação. Veja os exemplos:
|
|
|
|
2 Carbonos + INOEtino
|
Ligação tripla no Carbono 2 + 5 Carbonos + INO2-Pentino
|
Ligação tripla no Carbono 1 + 4 Carbonos + INO1-Butino
|
Obs: O Etino também é chamado de Acetileno.
|
Nomenclatura de Hidrocarbonetos Ramificados
|
Os Hidrocarbonetos são considerados ramificados quando apresentam em sua estrutura um Carbono que seja Terciário ou Quaternário. Suas regras de nomenclatura envolvem conhecimento de numeração e nomes de radicais e, para melhorar o aprendizado, estão divididas em Nomenclatura de Hidrocarbonetos de Cadeia Aberta, Cíclicos e Aromáticos.
Hidrocarbonetos de Cadeia Aberta
|
Está dividida em Hidrocarbonetos Saturados e Insaturados. Para dar nomes a estas estruturas, é necessário destacar a cadeia principal e os radicais, dando seus nomes e indicando através de numeração (sempre os menores números possíveis) a posição dos radicais. O que muda entre os Hidrocarbonetos Saturados e Insaturados é o meio de se achar a cadeia principal. Acompanhe os dois casos:
Hidrocarbonetos Saturados
|
Nos Hidrocarbonetos Saturados, isto é, naqueles que só apresentam ligações simples em sua estrutura, a cadeia principal é a seqüência que possui o maior número de Carbonos. Em casos de duas cadeias principais com o mesmo número de Carbonos, a cadeia principal é a mais ramificada. O Carbono 1 é aquele que faz com que a estrutura tenha os menores números para indicar a posição dos radicais. Quando a estrutura tiver dois ou mais radicais igual, colocamos apenas uma vez o nome deste radical antecedido do prefixo di, tri, tetra, etc de acordo com a sua quantidade e colocamos as suas respectivas posições. Acompanhe os exemplos abaixo:
|
|
|
Radical:Metil (Carbono 2)
|
Cadeia Principal:Propano
|
Radicais:Metil (Carbonos 3 e 4)Etil (Carbono 5)Isopropil (Carbono 5)
|
Cadeia Principal:Octano
|
Metil-Propano(não é necessário numerar pois não há outra posição para o radical)Este composto também é chamado de Isobutano
|
5-Etil-3,4-Dimetil-5-Isopropil-Octano(Note que neste caso a cadeia principal não foi uma seqüência representada numa linha reta)
|
Ordem Alfabética
Normalmente, na nomenclatura dos compostos ramificados, os radicais aparecem escritos pela ordem de complexidade (do menor para o maior). Esta é a regra mais utilizada no Brasil. A IUPAC, porém, aboliu esta regra em 1979. É recomendado que, ao nomear um composto qualquer ramificado, o nome dos radicais deve ser organizado em ordem alfabética (ignorando os prefixos iso, sec, terc, di, tri, etc).
Hidrocarbonetos Insaturados
|
Os hidrocarbonetos insaturados são aqueles que contêm pelo menos uma ligação dupla ou tripla em sua cadeia. Nestes casos, a cadeia principal é a maior seqüência que contiver a ligação dupla ou tripla e o Carbono 1 será o Carbono mais próximo da insaturação. Acompanhe dois exemplos:
|
|
|
Radicais:Metil (Carbonos 4,5 e 5)Isopropil (Carbono 3)
|
Cadeia Principal:Hepteno
|
Ligação Dupla:Carbono 2
|
Radicais:Metil (Carbono 4)Etil (Carbono 3)
|
Cadeia Principal:Hexino
|
Ligação Tripla:Carbono 1
|
3-terc-butil-4,5,5-Trimetil-2-Hepteno
|
3-Etil-4-Metil-1-Hexino
|
Hidrocarbonetos de Cadeia Fechada
|
Os ciclos seguem uma regra de numeração parecida com os compostos de cadeia aberta. A intenção é sempre utilizar os menores números possíveis. A cadeia principal é sempre o ciclo e a nomenclatura está dividida para os Ciclos Saturados e Insaturados.
Nos ciclos saturados contendo apenas um radical, não é necessário numerar. Naqueles que tiverem mais de um radical, o Carbono 1 é aquele que faz com que a estrutura tenha os menores números possíveis, sendo colocado preferencialmente sobre o menor radical. A numeração pode girar em sentido horário ou anti-horário. Acompanhe os exemplos:
|
|
|
Radicais:Metil (Carbono 1)Etil (Carbono 2)
|
Cadeia Principal:Ciclohexano
|
Radicais:Metil (Carbonos 1 e 3)Terciobutil (Carbono 2)
|
Cadeia Principal:Ciclopentano
|
2-Etil-1-Metil-Ciclohexano
|
2-Terc-butil-1,3-Dimetil-Ciclopentano
|
Nos Ciclos Insaturados Ramificados, a numeração deve começar sempre por um dos Carbonos da insaturação, de modo que ela fique entre os Carbonos 1 e 2. A numeração deve continuar ao longo do anel, de forma a se obterem os menores números possíveis para os radicais. No caso dos insaturados, não é necessário indicar a posição da insaturação, mas deve-se indicar a posição dos radicais, mesmo quando o Ciclo só tiver uma ramificação.
|
|
|
Radical:Metil (Carbono 3)
|
Ciclo:Ciclopenteno
|
Radicais:Metil (Carbonos 1 e 3)Etil (Carbono 6)
|
Ciclo:Ciclohexeno
|
3-Metil-Ciclopenteno
|
6-Etil-1,3-Dimetil-Ciclohexeno
|
Hidrocarbonetos Aromáticos
|
Os Hidrocarbonetos Aromáticos Ramificados possuem sistemática de nomenclatura bem peculiar. Se forem originários do benzeno, seguem a regra simples dos menores números, com algumas particularidades. Os originários do Naftaleno possuem sistema simples para indicar uma ramificação e numeração fixa para dois radicais. Acompanhe cada tipo de Aromático separadamente:
Hidrocarbonetos Aromáticos Ramificados Originados do Benzeno
|
Para ramificados benzênicos temos regras de numeração simples. Para apenas um radical, não é necessário indicar a posição. Para radicais iguais, o Carbono 1 é aquele que faz com que a cadeia tenha os menores números possíveis. Para radicais diferentes, o Carbono 1 é aquele contiver o radical mais simples e a numeração deve seguir de modo a se obterem os menores números possíveis para os outros radicais. Quando o ramificado benzênico apresentar apenas dois radicais, suas posições podem ser indicadas de outra maneira, utilizando-se prefixos:
Prefixo
|
Posições dos Radicais
|
orto- ou o-
|
1 e 2
|
meta- ou m-
|
1 e 3
|
para- ou p-
|
1 e 4
|
Assim, veja os exemplos abaixo:
|
|
|
Radicais:Metil (Carbono 1)Etil ( Carbono 3)
|
Ciclo:Benzeno
|
Radical:Fenil
|
Ciclo:Benzeno
|
3-Etil-1-Metil-Benzeno ou Etil-Meta-Metil-Benzeno
|
Fenil-Benzeno
|
Hidrocarbonetos Aromáticos Ramificados Originados do Naftaleno
|
Os aromáticos do Naftaleno possuem um sistema de nomenclatura parecido com o do Benzeno, mas sua numeração é característica. Os Carbonos são divididos em e , de acordo com sua posição. O Carbono 1 é sempre um dos Carbonos e o Carbono 2 deve ser um Carbono , para evitar erros de numeração. Veja quais são os Carbonos e na molécula de Naftaleno:
Para dar nome a um aromático com apenas um radical, basta indicar a posição com sua respectiva letra grega. Com dois ou mais é recomendado utilizar a numeração, conforme os exemplos abaixo:
|
|
|
Radicais:Metil (Carbono )
|
Ciclo:Naftaleno
|
Radicais:Metil (Carbono 1)Etil (Carbono 3)
|
Ciclo:Naftaleno
|
-Metil-Naftaleno
|
3-Etil-1-Metil-Naftaleno
|
São Hidrocarbonetos que apresentam cadeias fechadas.
Ciclanos, Cicloalcanos ou Cicloparafinas
|
São hidrocarbonetos cíclicos contendo apenas ligações simples. Sua nomenclatura é simples: usamos a terminaçãoANO e colocamos antes do nome o prefixo CICLO, para indicar que a cadeia é cíclica. Acompanhe alguns exemplos:
|
|
|
|
Ciclo + 3 Carbonos + ANOCiclopropano
|
Ciclo + 4 Carbonos + ANOCiclobutano
|
Ciclo + 7 Carbonos + ANOCicloheptano
|
São hidrocarbonetos cíclicos contendo uma ligação dupla. Sua nomenclatura é igual a dos Alcenos, acrescido do prefixo CICLO antes do nome do composto. Não há necessidade de numerar a posição da dupla ligação. Veja abaixo:
|
|
|
|
Ciclo + 5 Carbonos + ENOCiclopenteno
|
Ciclo + 6 Carbonos + ENOCiclohexeno
|
Ciclo + 4 Carbonos + ENOCiclobuteno
Fonte:www.ebah.com
|
 Combustão é uma transformação química (Foto: O Globo)
Combustão é uma transformação química (Foto: O Globo) Folha em decomposição (Foto: Flickr)
Folha em decomposição (Foto: Flickr)